زیست فناوری در آبزی پروری
مقدمه
بنابر اعلام سازمان خواربار و کشاورزی ملل متحد (Fao)، میزان ذخایر ۶۰ تا ۷۰ درصد ماهیان دریایی به علت صید بی رویه با تهدید رو به رو می باشد. متاسفانه مدیریت منابع گرانبهای دریایی به یکی از بزرگترین و مهمترین چالش های پیش روی بشر تبدیل شده است. در ۵۰ سال اخیر، با تخریب زیستگاههای آبزیان، تخلیه زبالهها و پسابها در رودخانهها و دریاها، بهرهبرداری بیش از حد از منابع زنده، بسیاری از این منابع ارزشمند در معرض نابودی و انقراض قرار گرفته اند.
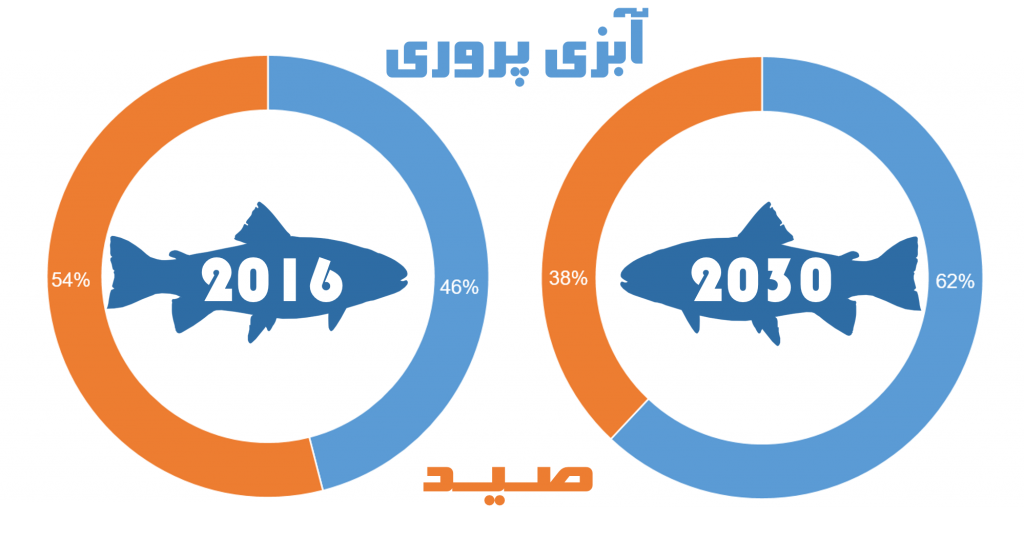
پیشبینی تغییر سهم هر یک از فعالیت های شیلاتی تا سال ۲۰۳۰ میلادی
در سال ۲۰۱۶ میزان تولید شیلاتی جهان، شامل صید و پرورش آبزیان، برابر با ۱۷۱ میلیون تن بوده که حدود ۸۰ میلیون تن مختص به آبزی پروری است. طبق آمار های جهانی تا سال ۲۰۳۰ میزان مصرف آبزیان توسط انسان روند افزایشی داشته و و تامین این نیاز بیشتر بر دوش صنعت آبزی پروری خواهد بود. با نگاه به وضعیت ذخایر طبیعی آبزیان در پهنه های آبی، آبزی پروری تنها راه برای افزایش مداوم تولید غذاهای دریایی محسوب می گردد. فائو تخمین زده است که آبزی پروری بین سال های ۲۰۱۵ تا ۲۰۲۵ تقریبا نیمی از کل ماهی مصرفی جهان را تولید خواهد نمود.
با درنظرگرفتن رشد تصاعدی جمعیت جهان و نقش محصولات شیلاتی در تغذیه بشر، استفاده از زیست فناوری هایی که منجر به تولید بیشتر در واحد سطح یا حجم پرورش شوند بسیار ضروری و غیرقابل اجتناب خواهند بود. در این میان به کارگیری زیست فناوری های نوین چون پرورش آبزیان تراریخته[۱] و یا آبزیان اصلاح نژاد شده با قابلیت رشد بیشتر، با قابلیت تحمل بیماری های ویروسی و باکتریایی و همچنین با قابلیت استفاده از مواد غذایی ارزانتر و تولید پروتئین بیشتر یکی از راهکارهای اصلی در طراحی و توسعه پایدار آبزی پروری نوین است.
بیوتکنولوژی یا زیست فناوری چیست؟
زیست فناوری مجموعه ای از علوم و تکنیک هاست که در آن از ارگانیسمهای زنده و مفید برای تولید، تغییر و اصلاح فرآوردهها، بهنژادی گیاهان و جانوران و تولید ارگانیسمهای خاص برای کاربردهای ویژه، استفاده می شود. مثال هایی ساده از زیست فناوری شامل فرآیند تخمیر در پخت نان توسط باکتری ها، بهگزینی جانوران و گیاهان با ویژگی های برتر تولیدی و زیبا شناختی و همچنین استفاده از آنتی بیوتیک ها در درمان بیماری های باکتریایی است که از دیرباز توسط انسان برای بهبود کیفیت سلامت و زندگی استفاده شده اند.
زیست فناوری دریایی
زیست فناوری دریایی به معنای استفاده از موجودات آبزی برای بهبود و افزایش کیفیت زندگی انسان و یا تولید محصولات دریایی است که به طور مستقیم یا غیرمستقیم در زندگی انسان تأثیر دارند. در واقع به استفاده از موجودات آبزی با هدف افزایش غذای تولید شده برای انسان، تولید مواد یا داروهای بهبود بخش سلامت انسان و ردیابی آلودگی ها در طبیعت اطلاق می شود.
چگونه زیست فناوری به افزایش تولید در آبزی پروری کمک خواهد کرد؟
ایجاد بانک ژن
با در نظر گرفتن نقش محصولات شیلاتی در تغذیه بشر، رشد تصاعدی جمعیت و روند خطی تولید محصولات آبزی پروری، شناخت ذخایر ژنتیکی آبزیان، امری ضروری به نظر می رسد. لازمه افزایش تولیدات شیلاتی جمع آوری، حفظ و نگهداری و ارزیابی ذخایر ژنتیکی آبزیان است. بر این اساس بانک های ژن در اقصی نقاط جهان تاسیس شده است تا رسالت حفظ میراث ذخایر ژنتیکی گونه های مختلف را عهده دار باشند. مسلم است که موفقیت آینده متخصصین اصلاح نژاد آبزیان، به حفظ ذخایر ژنتیکی امروز آبزیان بستگی مستقیم دارد تا بتوانند از آن در برنامه های اصلاح نژاد خود استفاده نمایند.
نگهداری مطلوب از ذخایر ژنتیکی آبزیان و حفظ تنوع زیستی آنان با استفاده از روشهای زیست فناوری از مهمترین اهداف ایجاد بانک های ژن در جهان است. از جمله دیگر وظایف بانک ژن می توان به جمع آوری نمونههای بیولوژیک گونههای مختلف آبزیان، آمادهسازی و نگهداری بلندمدت آن ها، ثبت ژنتیکی گونههای در معرض تهدید و در حال انقراض و استفاده از تکنیک های زیست فناوری برای حفظ بقا و مدیریت گونههای آبزی اشاره نمود.
از طرفی بانک های ژن برای مراکز تکثیر ماهیان نیز کاربردهای فراوانی دارد. بانک ژن می تواند تنوع ژنتیکی را به مراکز تکثیر ارائه دهد و با استفاده از اسپرم منجمد شده ماهیان در برنامه های اصلاح نژادی، گونه های اصلاح شده خاص را تولید نمایند. بهبود ژنتیکی مولدین یا تکثیر گونه ها برای صفاتی مانند مقاومت در برابر بیماری، نرخ رشد سریع و تحمل به شوری می تواند با ایجاد بانک منجمد اسپرم امکان پذیر گردد.
تکنولوژی دستکاری ژن
تکنولوژی دستکاری ژن به تکنیک هایی اطلاق می گردد که در تغییر یا جابجایی مواد ژنتیکی گیاهان یا حیوانات مورد استفاده قرار می گیرد. این امر امکان انتقال مواد ژنتیکی در بین گونه های مرتبط یا غیرمرتبط را فراهم می کند. در برنامه های تولیدی سنتی، تنها گونه هایی که ارتباط نزدیکی با هم داشته باشند با هم پیوند داده می شوند.
در سالیان اخیر مطالعات متعددی بر روی دستکاری های ژنتیکی در گونه های جانوری تدوین شده و پژوهش ها بر روی آبزیان رشد فزاینده ای داشته است. امروزه در سطح جهان مطالعات ژنتیکی بر روی ۳۵ گونه آبزی در حال انجام است. گونه های شاخص شامل قزل آلا، میگو، گربه ماهی، تیلاپیا، چینوک، کوهو و دیگر اعضای خانواده آزاد ماهیان هستند.
توجه داشته باشید که ماهیت آزمایش های مهندسی ژنتیک به گونه ای است که تنها در آزمایشگاه های تحقیقاتی بیوتکنولوژی، دانشگاه ها یا موسسات وابسته به دولت قابل اجراست. این آزمایش ها نیاز به ابزار و تکنیک های ویژه ای داشته که در مزارع قابل اجرا نیست. با این حال گونه های تولید شده در این فرآیند قابل پرورش در مزارع آبزیان می باشند.
مهمترین کاربرد زیست فناوری آبزیان تراریخته، استفاده از قابلیت افزایش رشد توسط انتقال ژن های هورمون رشد آبزیان با پتانسیل رشد بالاتر می باشد. از این طریق، ژن هورمون رشد به ماهی جدید انتقال یافته و منجر به رشد بالاتر آن موجود می گردد. ماهی گلدفیش (Carassius auratus) اولین ماهی تراریخته ای است که در سال ۱۹۸۵ میلادی تولید و ژن هورمون رشد انسانی به جنین آن تزریق شده است. از سال ۱۹۸۵روش های متفاوتی برای تولید ماهی تراریخته انجام شده است که شامل روش های ریزتزریقی[۲]، الکتروپورشن[۳]، آلودگی با وکتورهای رتروویروسی[۴]، تفنگ ژنی[۵] و انتقال ژن توسط اسپرم[۶] می باشد.
تمایل بیشتری برای تراریخته کردن ماهی نسبت به دیگر جانوران وجود دارد. چون ماهی صفات اقتصادی سودمندی داشته و جالب توجه این است که با تراریخته کردن، بسیار مؤثرتر از روش اصلاح نژاد میتوان این صفات را بهبود بخشید.
تاکنون، بیشتر آبزیان تراریخته تولید شده از ماهیان آب شیرین بوده اند چون نگهداری و تخمریزی این ماهیان در شرایط آزمایشگاهی آسان می باشد. در مقابل، توجه اندکی به ماهیان دریایی معطوف گشته است، برخلاف اینکه این ماهیان از ارزش اقتصادی بالایی در صنعت آبزی پروری برخوردارند.
اغلب مطالعات صورت گرفته در زمینه آبزیان تراریخته با اهداف زیر بوده است:
- افزایش سرعت رشد
- توانایی تطابق با محیط های نامناسب از قبیل مقاومت در برابر یخ زدن و سرما
- افزایش مقاومت نسبت به بیماری ها
- کنترل بلوغ جنسی، باروری و تمایز جنسی
- افزایش بهره وری غذایی
- افزایش میزان بازارپسندی از قبیل تنوع رنگی و بهبود طعم گوشت
تولید ماهیان تراریخته دریایی به منظور افزایش رشد
بدین منظور، مطالعات زیادی روی بسیاری از ماهیان مهم اقتصادی مثل اعضای پرورشی خانواده آزادماهیان مثل آزاد ماهی اقیانوس اطلس (Salmo salar)، ماهی شانک قرمز (Pagrosomus major)، ماهی سیم دریایی نقره ای (Sparus sarba) و هامور گوژپشت (Cromileptes altivelis)، برای افزایش رشد از طریق انتقال ژن رشد انجام شده که موفقیت آمیز نیز بوده است. اما، از میان این ماهیان، تنها یک ماهی مسیرهای تجاری شدن را پیموده است.
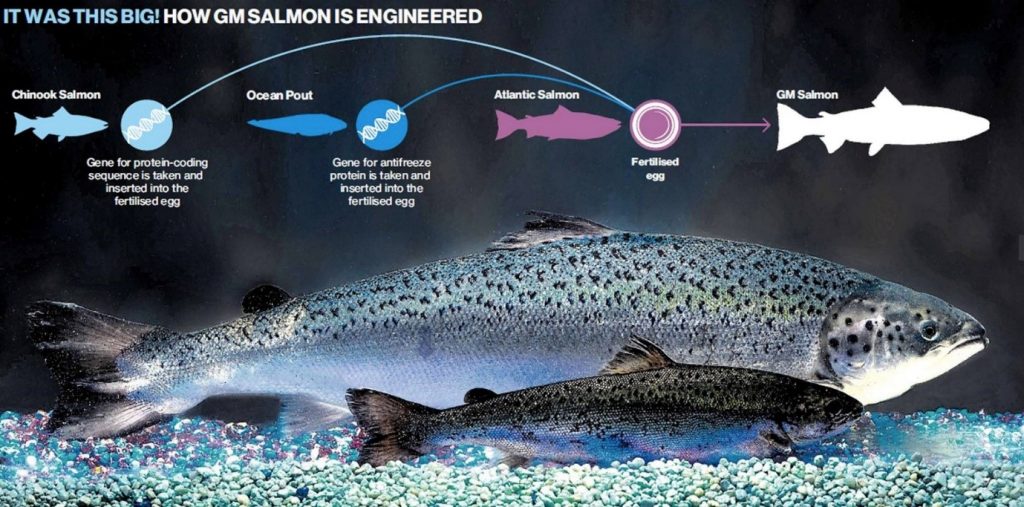
در همین راستا، نسل جدیدی از ماهی آزاد اقیانوس اطلس (Salmo salar) با نام ماهی آزاد ((Aqua Advantage)) توسط شرکت ((Aqua Bounty Technologies)) تولید شده است که به خاطر دریافت هورمون رشد ماهی آزاد چینوک (Oncorhynchus tshawytscha) که از نظر ذاتی بزرگترین ماهی آزاد می باشد، دارای رشد بیشتری نسبت به ماهی آزاد اقیانوس اطلس می باشد. این ماهی مراحل مقدماتی مجوز تولید و پرورش را در کشور آمریکا از سازمان غذا و داروی جهانی (FDA)[۷] دریافت کرده است. با در نظر گرفتن احتمال فرار ماهیان تراریخته به طبیعت، برای جلوگیری از در معرض خطر قرار گرفتن ژنوم ماهیان سالمون اطلس در زیست بوم طبیعی، گونه تجاری که مجوز پرورش را دریافت کرده است به شکل تریپلوئید تمام ماده در فرآیند پرورش و رسیدن به دست مصرف کننده طراحی شده است.
ماهی سیم دریایی نقره ای از جمله ماهیان اقتصادی مهم در آسیا می باشد که زیست فناوری انتقال ژن رشد در این ماهی نیز انجام شده است. تراریخت کردن آن و همچنین یافتن روش انتقال ژن مناسب برای این ماهی، دستاورد بزرگی برای بهبود صفات ژنتیکی در ماهیان دریایی بوده است. این ماهی با استفاده از ژن هورمون رشد ماهی قزل آلا همراه با پیشبر ژن (بتا-اکتین) ماهی کپور معمولی تراریخته شده است. در این کار از دو فناوری انتقال ژن از طریق اسپرم و انتقال ژن به بیضه جانور استفاده شده است که به ترتیب منجر به افزایش رشد بیشتر % ۵۶ و % ۷۶در این ماهی شده است. همچنین میزان عملکرد رشد و ترکیب لاشه از نظر میزان پروتئین و چربی در ماهی تراریخته با ماهی شاهد مقایسه شده و نتایج نشان داده است که القای ژن رشد در این ماهی باعث کاهش محتوای چربی تا % ۵۰ و افزایش میزان پروتئین و رشد در آن شده است. اینها صفاتی مطلوب در گونه های پرورشی به حساب می آیند.
ماهی هامور نیز یکی از گونه های مهم پرورشی در آسیا می باشد. مشکل اصلی پیش روی پرورش هامور، نرخ رشد اندک آن می باشد. برای مثال، برای رسیدن به وزن بازاری حدود ۰/۵ – ۱ کیلوگرم این ماهی، به هشت تا بیش از ۲۴ ماه زمان نیاز است. این رشد اندک هزینه های پرورش این ماهی را به طور قابل ملاحظه ای افزایش می دهد. بنابراین، برای حل این مشکل روش مؤثرتر و کاراتر تراریخته کردن بررسی شده است. در ماهی هامور گوژپشت کارایی سه روش ریزتزریق، ترانسفکشن (قرار دادن اسپرم در معرض محلول DNA قابل انتقال) و الکتروپوریشن ) انتقال DNA از طریق جریان الکتریکی) برای انتقال ژن رشد بررسی شده است. هرچند امکان انتقال ژن رشد به هامور در هر سه روش وجود داشته، اما از دیدگاه سهولت و کارایی، روش مناسب برای انتقال ژن در این ماهی الکتروپوریشن گزارش شده است.
تولید ماهی تراریخته دریایی با قابلیت تحمل آب های زیر صفر درجه سانتی گراد
ایده استفاده از پروتئین ژن «ضد یخ زدگی[۸]» اولین بار از آنجا شکل گرفت که چگونه ماهیان دریایی در دماهای زیر صفر درجه سانتیگراد نسبت به ماهیان آب شیرین که در آب های با دماهای بالای صفر درجه سانتیگراد حضور دارند، قابلیت زنده مانی بیشتری دارند. پروتئین ضدیخ از یک سری از پپتیدها و گلیکوپپتیدها تشکیل شده است. این پپتیدها از سلول های کبدی ترشح شده و در خون و فضای بین سلولی وجود دارند. این پپتیدها به کریستال های یخی متصل شده و آنها را تغییر می دهند. بدین ترتیب مانع تشکیل کریستال یخ شده و نقطه انجماد مایعات بدن را کاهش می دهند. تکنولوژی تولید این نوع ماهی برای تولید پروتئین ضد یخ در کشورهایی که سواحل خیلی سرد دارند و دمای آب تا ۸/۱- درجه سانتی گراد می رسد مثل سواحل کانادا و کشورهای اسکاندیناوی که مبادرت به پرورش ماهیان آزاد می کنند، کاربرد دارد.
هرچند با وجود آنکه ماهی تراریخته سالمون حاوی ژن ضدیخ به راحتی تولید شده و ژن آن در بافت ماهی بیان شده و از طریق سلولهای جنسی نیز به نسل بعد انتقال پیدا کرده است، اما نتوانسته قابلیت ضدیخ بودن را برای ماهی به ارمغان بیاورد. علت این امر می تواند به این موضوع مرتبط باشد که این ژن می بایست به میزان بیشتری بیان شود. همچنین این احتمال وجود دارد که لازم است این ژن پروتئینی را تولید کند که به شکل عملکردی قابلیت بالاتری داشته باشد؛ و یا در بافت هایی مثل سلول های اپیتلیال پوست یا بافت کبد میزان بیان بیشتری داشته باشد.
کنترل بیماری های آبزیان پرورشی از طریق تولید آبزیان مقاوم به بیماری
صنعت پرورش ماهی و آبزیان به جهت پرورش با تراکم بالا مستعد بروز بیماری های ویروسی و باکتریایی بسیاری می باشد. استفاده از آنتی بیوتیک ها یکی از ابتدایی ترین راه های جلوگیری از ابتلا جانور به بیماری باکتریایی است، اما تنها تعداد کمی از آنتی بیوتیک ها در پرورش آبزیان مجوز استفاده دارند. همینطور بسیاری از واکسن های بیماری های آبزیان که در بازار وجود دارد برای برخی از گونه ها کارآمد نمی باشند. از سویی دیگر ساختن «DNA واکسن ها» نیز بسیار مشکل می باشد و نیازمند تجهیزات آزمایشگاهی پیچیده است و از همه مهمتر اینکه هنگام تزریق، استرس زیادی به آبزی وارد می سازد. برخی از پروتئین ها و پپتیدهایی شناسایی شده اند که خاصیت ضد باکتریایی و ویروسی دارند.
به طور مثال «سکروپین[۹]» پپتیدی است که اولین بار در شاپرک (Hyalophora cecropia) شناسایی شده و خاصیت ضد باکتریایی وسیعی دارد. این پپتید در تنباکو و سیب زمینی به عنوان پپتید ضدمیکروب برای مقاوم کردن این دو گیاه استفاده شده است. این پپتید بر ضد باکتری Edwardsiella ictalurii و باکتری Flavobacterium columnare به کار گرفته شده و ماهیان تراریخته با این پپتید ۴۰ تا ۱۰۰ درصد نسبت به جمعیت غیرتراریخته مقاومت ضد باکتریایی از خود نشان داده اند.
پروتئین لاکتوفرین انسانی که جز پروتئین های غیراختصاصی سیستم ایمنی است، در کشاورزی برای استفاده از خواص ضد باکتریایی و ویروسی در پرورش تنباکو و سیب زمینی استفاده شده است. این پروتئین در آبزی پروری برای جلوگیری از بیماری هموراژی ویروسی در ماهی کپور علفخوار (Ctenopharyngodon idella) استفاده شده و مشخص شده است که ماهیان تراریخته تا ۳۶ درصد بازماندگی داشته اند.
افزایش بهره وری غذایی در ماهیان تراریخته
تلاش دیگر برای استفاده از مواد گیاهی در جیره غذایی آبزیان استفاده از ژن های آنزیم فیتاز است که فیتات را می شکند. بیشترین فرم فسفر در منابع گیاهی به شکل فیتات است که برای ماهی غیرقابل استفاده است و اگر ماهی از منابع غذایی حاوی فیتات استفاده کند، آن را به صورت هضم نشده در محیط رها می سازد. در نتیجه، با تجزیه میکروارگانیسم ها فسفر زیادی در طبیعت رها شده که منجر به آلودگی محیط می شود. چون ماهی توانایی استفاده از فسفر با قابلیت دسترسی زیستی را ندارد باید به شکل غیر آلی به جیره غذایی اش اضافه شود. اگر فیتاز به غذای ماهی اضافه شود به جهت فرآیند گرمایی که برای عمل آوری غذا انجام می شود، ممکن است این آنزیم از بین برود. بنابراین تولید ماهیان تراریخته ای که بتوانند فیتات را مصرف کنند از اهمیت ویژهای در آبزی پروری برخوردار است. مطالعاتی در زمینه تولید ماهی مداکا حاوی ژن فیتاز انجام شده است.
عقیم سازی
مهمترین دستکاری در سطح جهانی در آبزی پروری عقیم سازی است که از طریق دستکاری پلی پلوئیدی انجام می شود. این تکنیک در راستای ایجاد موجوداتی با کپی های اضافی کروموزوم استفاده می شود و در نتیجه باعث عقیم شدن ماهی می شود. ماهیان عقیم انرژی خود را برای تولید اسپرم و تخمک مصرف نکرده و این انرژی در جهت افزایش تولید ماهیچه به کار گرفته می شود. به ندرت می توان موجودات تریپلوئید را در طبیعت مشاهده نمود. تریپلوئیدها موجودات تراریخته (GMO)[۱۰] نیستند چرا که ژن جدیدی ندارند. شاید ایجاد گونه های تریپلوئید تنها روش قابل اجرا و اقتصادی در محیط مزارع برای افزایش تولید گوشت ماهی باشد.
روش دیگر عقیم کردن از طریق مسدود کردن مسیر تولید گنادوتروپین ها (GTH) می باشد. هورمون آزاد کننده گنادوتروپین (GnRH) مسئول بلوغ جنسی در ماهی ها و محرک آزاد سازی گنادوتروپین از غده هیپوفیز می باشد. توالی ژن هورمون آزاد کننده گنادوتروپین تعدادی از گونه ها جداسازی و کلون شده است. در همین راستا دانشمندان در جستجوی روشی برای عقیم کردن ماهی بوسیله تکنولوژی آنتی سین یا ریبوزین به منظور انسداد مسیر بیان ژن GnRH هستند.
با افزایش جمعیت انسان روی کره زمین تنها راه تأمین غذا برای جوامع انسانی در دهه های آتی، افزایش پرورش دام، طیور و آبزیان می باشد. استفاده از آبزیان یکی از راه های دستیابی به گوشت سفید با کیفیت و مقرون به صرفه اقتصادی از نظر پرورش است. ظرفیت صید از آبها محدود است و برخلاف آنکه در سالهای آتی افزایش خواهد داشت اما رشد پرورش آبزیان برای جمعیت فزاینده، روز به روز در حال افزایش است. تنها راه دستیابی به محصول بیشتری از گوشت سفید، پرورش آبزیانی با بازده تولید بیشتر می باشد. از سویی دیگر، چشم انداز آینده زیست فناوری انتقال ژن در پرورش آبزیان بسیار روشن است.
استفاده از این زیست فناوری برای تولید آبزیان تراریخته با قابلیت رشد بیشتر، ماهیان تراریخته مقاوم به بیماری، ماهیان تراریخته با قابلیت متابولیکی در استفاده از کربوهیدرات ها و تولید اسیدهای چرب غیراشباع ضروری به نظر می رسد. بسیاری از کشورهای پیشرفته مبادرت به دستیابی تولید ماهیان با قابلیت تولید بیشتر کرده اند، اما مطالعات آنها تنها معطوف به این مسأله نبوده است. از این منظر برای جلوگیری از رهاسازی و آمیختگی ماهیان تراریخته، تولید لاینی از ماهی تراریخته که تریپلوئید باشد و درصورت آزادسازی نتواند با ماهیان زیست بوم طبیعی تکثیر کند، منطقی و هوشمندانه به نظر می رسد.
چنانچه در این مقاله اشاره شد، انتقال ژن های مختلف به ماهیان دریایی منجر به نتایج مطلوبی شده است. هرچند که استفاده از موجودات تراریخته در آبزی پروری بحث برانگیز است، اما کوتاهترین و مؤثرترین راه برای ایجاد لاین های خاص و مولدین کارا، ناگزیر از به کار بردن روش های نوین زیست فناوری مانند انتقال ژن می باشد. زیرا که روش های اصلاح نژاد سنتی بسیار زمانبر و پرهزینه هستند و در مسیر انتخاب یک صفت خاص، ممکن است صفات مطلوب دیگر حذف شوند.
کاربردهای احتمالی دستکاری ژن آبزیان در آینده شامل موارد زیر می باشد:
- افزایش ماهیان دریایی در آب شیرین
- دستکاری طول چرخه های تولید مثل
- افزایش تحمل گونه های آبزی پروری به رنج گسترده شرایط محیطی
- افزایش کیفیت طعم گوشت ماهی و سایر آبزیان
- کنترل بلوغ جنسی برای جلوگیری از کاهش کیفیت لاشه با استفاده از افزایش سن بلوغ ماهی
- استفاده از ماهی های ترانس ژنتیک به عنوان پایش های آلودگی
- کنترل تمایز جنسی و تعیین جنسیت
- افزایش توان جذب کربوهیدرات توسط آبزیان گوشت خوار در جهت جایگزینی پروتئین گیاهی با پروتئین جانوری
- استفاده از ماهی با هدف تولید محصولات دارویی
- نشان دار کردن ماهی با توالی های DNA نشانگر در راستای تسهیل مطالعه جمعیت ماهیان
[۱] Transgenic
[۲] Microinjection
[۳] Electroporation
[۴] Retroviral vectors
[۵] Shutgun
[۶] Sperm mediated gene transfer
[۷] Food and Drug Administration
[۸] Anti freeze protein
[۹] Cecropin
[۱۰] Genetically Modified Organisms
“جهت دریافت متن کامل این مقاله به صورت PDF بر روی لینک زیر کلیک نمایید”